果汁通电:将应用电分析化学融入本科课程
Dhésmon Lima, Vikram Singh, Karishma Bulleeraz, Joey A. Lussier, and Sabine Kuss*
引用本文: J. Chem. Educ. 2024, 101, 2938-2946 在线阅读 关于合法分享已发表文章的选项,请参见 https://pubs.acs.org/sharingguidelines。
0 摘要
便携式设备推动了电分析化学的发展,为检测具有高灵敏度和准确度的分析物提供了方法和传感器。电化学的这一子领域在工业和分析质量控制领域具有普遍的应用潜力。这导致对能够操作台式和便携式电分析设备的受训人员的需求日益增长。尽管电化学技术在本科理论课程中是常规教学内容,但它们需要更频繁地被纳入实验教学活动中。在此,我们描述了一个有效、动手实践且低维护成本的实验应用,该实验可以增强学生对电分析方法及其在工业质量控制环境中应用的体验。该活动基于使用未修饰的 玻碳电极 (GCE),通过循环伏安法检测真实果汁样品中的抗坏血酸(维生素C)。这个教学实验向学生传授了循环伏安法的理论概念、三电极体系的设置、化学可逆性、数据处理和定量分析。这种教学方法在一个二年级的分析化学课程中实施,并轻松适应了COVID-19大流行期间实施的社交距离措施。
玻碳电极 (GCE),通过循环伏安法检测真实果汁样品中的抗坏血酸(维生素C)。这个教学实验向学生传授了循环伏安法的理论概念、三电极体系的设置、化学可逆性、数据处理和定量分析。这种教学方法在一个二年级的分析化学课程中实施,并轻松适应了COVID-19大流行期间实施的社交距离措施。
关键词:教学实验室,分析化学,抗坏血酸,电化学,伏安法
1- 引言
电分析是分析化学的一个强大分支,在从基础研究到(生物)医学和制药工业等领域有着无数的应用。与光谱法和色谱法等其他传统分析方法一样,电分析在分析我们日常生活中遇到的样品方面显示出巨大优势。电分析方法已被证明是灵敏、经济且环保的替代方案,能够对不同复杂程度样品中的分析物进行精确测定。例如,这些技术已被应用于定性和定量检测药物、维生素、蛋白质和生物分子,其检测限可达纳摩尔级别。
在不同的电分析仪器技术中,伏安法(循环伏安法、线性扫描伏安法、差分脉冲伏安法和方波伏安法)因其在定量分析中的价值而频繁被采用。这主要是由于其简单、高灵敏度和快速响应的特点,使得精确测定能够在短短几秒钟内完成。 在伏安实验中,一个电位扫描被施加到工作电极上,在电位窗口的限制范围内驱动氧化还原反应,同时记录电化学电流。如果一个电活性化合物在宏电极(毫米级别)上,在该电位区间内发生电化学转化,那么在得到的伏安图中将出现电流峰。峰高与化合物浓度成正比,因此可用于定量测定。 尽管电分析方法在本科理论课程中被广泛探讨,但将伏安法等电化学方法作为实验活动进行教学,应更有效地被纳入本科教育计划中。 Kovarik等人最近进行的一项研究证明了这一点,该研究对超过320名分析化学教师进行了课程调查,结果显示,与光谱法和色谱法等方法相比,学生在电分析技术方面的动手实验经验要少得多。 为此,特别需要将以电化学为中心的实验活动整合进来。这不仅能让学生更好地理解概念和发展思想,还能帮助他们
接收日期:2024年4月15日
修订日期:2024年5月22日
接受日期:2024年5月23日
发布日期:2024年6月11日

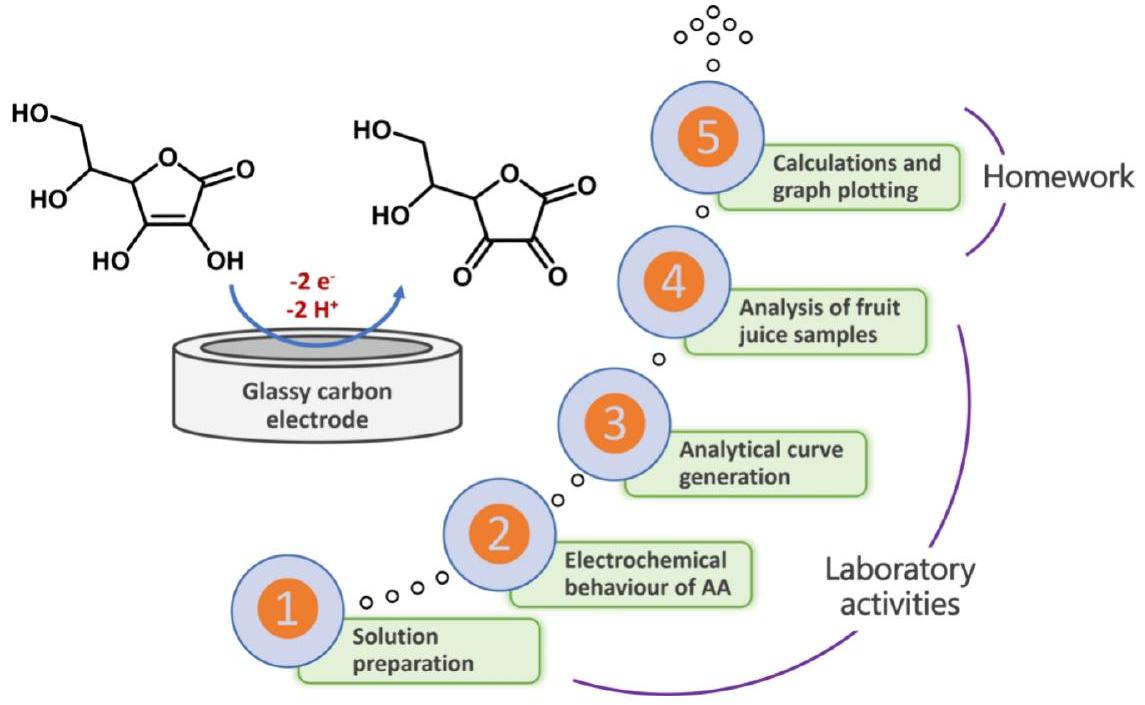
方案1. AA的电氧化机理及学生在所述活动中进行的实验步骤
通过动手演示更有效地学习。 许多有效的教学实验已被开发为引人入胜的策略,将电分析纳入分析化学实验课。例子包括对茶叶样品中黄酮类化合物的电化学研究和检测, 商业药物制剂中对乙酰氨基酚的检测, 唾液中皮质醇的检测, 牙齿美白贴片中过氧化氢的检测, DNA降解的研究, 以及软件模拟的使用。 除了教学实验,最近的出版物还描述了增强电化学学习的基本理论概念和方法,例如Elgrishi等人发表的循环伏安法教学指南。
在此,我们设计了一个有效、低维护成本且注重动手实践的伏安活动,用于分析化学实验课程。该教学实验基于使用未修饰的玻碳电极作为电化学传感器,通过循环伏安法 (CV) 检测真实果汁样品中的抗坏血酸 (AA)(广为人知的维生素C)。为了使该活动适用于教学环境,我们使用了便携式电分析仪器。该实验被证明能有效增强学生对循环伏安法及其潜在应用的认识。该程序的多功能性将使大学教授和讲师能够将其调整以适应不同课程级别(二年级至四年级),并可包含不同的分析物和真实样品,从而进一步增强其教学潜力。
2- 教学方法
所提出的活动被整合到曼尼托巴大学(加拿大温尼伯)于2020年、2021年和2022年为二年级本科生开设的分析化学实验课程的教学计划中。每年的学生人数在80到100人之间,他们被分成三个小组,每组平均有12-35名学生,以个人或两人一组的形式进行实验。每个小组在同一周的不同天内完成实验,实验时间为3小时。该实验活动在一系列侧重于经典容量分析法和光谱法的教学实验之后进行。因此,学生应已具备对分析化学基本概念(如使用玻璃器皿和配制溶液)的扎实理解和实践。
该活动的主要目标是向大学低年级学生介绍电分析及其在日常生活情境中的潜在应用。学习目标定义如下:(1)在实验课结束时,学生应能自信地描述一个电化学系统的一般组成。(2)学生应能回忆并解释电化学系统中各个组件的用途。(3)学生应能自信地讨论电化学实验背后的物理原理。
抗坏血酸 (AA),广为人知的维生素C,被选为分析物,考虑到它在食物中含量丰富,具有明确的电化学行为, 高溶解度, 易于获取且无毒。 AA是一种必需的营养素,参与许多重要的生物过程,如组织修复、胶原蛋白形成和多种酶的活性。 这种维生素在免疫系统功能中扮演重要角色, 并且是一种强效的抗氧化剂, 尽管长期以来也有报道称其在体内具有一些有害的促氧化剂效应。 在食品工业中,AA天然存在于果汁中,也常作为防腐剂添加到产品中。 考虑到所有这些重要作用,食品工业的质量控制需要精确的AA测定方法。
使用电分析方法测定AA已在文献中得到描述和验证, 因为该分析物具有众所周知的氧化还原性质,使其能够通过伏安法和安培法等技术被精确检测。AA在其两个可电离的羟基上发生电化学氧化(方案1),涉及两个电子和两个质子的转移,最终产物为脱氢抗坏血酸。 此外,AA众所周知的氧化还原化学特性,也使其被用作模型分析物,在分析化学实验课程中向本科生介绍电分析。
由于循环伏安法 (CV) 在提供定性和定量信息方面的简便性和有效性,它经常成为讲师们设计旨在量化真实样品中AA的教学实验的首选方法。例如,Samayoa-Oviedo等人报告了一个教学项目的结果,在该项目中,学生们比较了经典碘量滴定法、间接分光光度法和CV在定量膳食补充剂中AA方面的分析性能。 Silveira等人提出使用CV检测商业果汁样品中的AA,他们使用了商业铂电极和两种常见的分析方法:外标校准法和标准加入法。 King等人使用廉价的铅笔芯电极作为传感器,通过CV检测橙汁中的AA。 为了让学生接触研究中常用的电分析方法,Ito等人使用了一种更复杂的电化学传感器,该传感器基于用硫醇自组装单分子膜修饰的金电极,采用CV测定维生素C片剂中的AA。 这些例子清楚地展示了在实验课程中引入电分析活动是多么灵活,因为它不仅增强了学生在电化学方面的知识,还允许在实验过程中有效探索分析化学的其他相关概念。
我们的活动旨在扩展先前描述的、用于在分析化学教学实验室中引入电分析的教学方法。我们强调,该实验已整合到曼尼托巴大学的一门分析化学实验课程中,并已连续三年高效应用,即使在约有100名学生的大班中也是如此。使用便携式电化学装置,包括一个小型化的恒电位仪和一个平板电脑,使学生能够认识到电化学在提供现场分析方面的潜力,并让他们能够独立操作电化学设备和进行活动。因此,这种主动学习方法与纯粹基于演示的课程形成对比,在后者中,学生仅作为旁观者被动学习。此外,我们的活动依赖于易于获取、成本效益高且无需预先化学处理或修饰的电极。
通过视频和面对面讨论进行的基本组合式指导,为这3小时的实验活动奠定了基础。在实验开始前72小时,向学生提供了三个演示视频(视频链接请参见支持信息),详细解释了一般实验室安全、实验装置描述、数据收集程序以及数据解释的建议。 (i) 视频1:实验介绍。该视频(约25分钟)对实验进行了介绍,阐述了循环伏安法的基础知识、三电极装置,并讨论了实验的目的和流程。 (ii) 视频2:电极抛光。该视频(约3分钟)详细描述了宏电极的抛光过程。GCE表面使用三种不同粒度的氧化铝浆(1.0、0.3和0.05 μm)在尼龙抛光垫上进行抛光,然后用蒸馏水冲洗以去除抛光浆的任何痕迹。 (iii) 视频3:装置设置与分析。该视频(约6分钟)详细描述了电化学系统的布置。
该装置包括一个30 mL的电化学池(一个简单的玻璃小瓶),一个作为工作电极 (WE) 的GCE,一根作为对电极 (CE) 的铂丝,以及一根涂有氯化银的银丝作为准参比电极 (RE)。视频3指导学生如何将三个电极连接到恒电位仪,以及它们应如何在电化学池内放置。视频演示了如何收集数据以及如何操作软件。在我们的活动中,使用了一个简单的USB-C型电缆连接器(在电子产品商店中常见)。
学生被要求仔细观看演示视频,并提供隐藏在视频中的代码才能进入实验室。通过这种策略,我们确保只有理解了实验基础知识的学生才能参加课程。除了上述视频,还提供了一份详细的实验指南(实验手册),描述了所有溶液的制备和操作步骤(支持信息),使学生能够提前复习实验步骤。学生被要求携带一份书面实验流程到课堂上,其中描述了实验步骤以及该活动中使用的所有化学品的安全信息,这些流程在进行实验前由助教逐一检查。一旦获得进入实验室的许可,讲师在活动开始前会进行5-10分钟的介绍性欢迎简报。简报的主要目的是重温视频中的关键细节,并指导学生了解实验方案和相应的计算。此外,这次初步讨论也旨在解答学生们关于实验室安全和操作流程的常见问题。
实验活动由4个主要步骤组成。步骤1:第一步包括计算AA 储备溶液的摩尔浓度(约12.00 mM),以及配制工作溶液(1.00 mM)和标准溶液(0.06、0.12、0.18、0.23和0.30 mM)所需的计算。在这一步中,学生可以复习和练习在一年级实验室中学到的基本概念和技能,如溶液配制(从固体标准品和稀释)和摩尔浓度确定。所有溶液均在实验室技术员预先配制的0.1 M KCl溶液中制备。步骤2:设置好电化学系统后,学生使用CV和AA工作溶液评估AA的伏安行为。讨论了关于氧化电位、化学和电化学可逆性的相关细节。此外,讨论中还补充了关于AA的扩散行为及其在施加电位时在GCE表面的氧化。这是从根本上理解伏安法原理的关键步骤。重要的是,学生被要求在没有分析物的情况下记录一个空白伏安图,并结合上下文解释了电容电流和法拉第电流之间的差异。步骤3涵盖了使用CV为AA检测生成一条分析曲线。在配制了不同AA浓度的溶液后,学生需要为每个标准溶液收集循环伏安图。重点放在了阳极峰电流如何随分析物浓度的增加而变化,
以便学生能够理解循环伏安法如何应用于定量测定。步骤4:对提供给学生的商业果汁样品中的AA进行定量,这是该流程的最后一部分。在进行伏安分析之前,样品在0.1 M KCl中稀释(1:20)。虽然使用了三种类型的果汁,即苹果汁、蔓越莓汁和橙汁,但所介绍的程序可以扩展到任何含有大量AA的果汁,且样品的光学透明度无关紧要。
每个样品中AA的精确含量(精确到小数点后两位)已由讲师预先测定,通常是在学生分析前一天,但绝不超过一周。为了消除与AA降解相关的问题,果汁盒在4°C下避光储存,并且仅在学生进行实验前立即打开。此外,特别重要的是,含有相同口味果汁的包装应具有相同的批号。这将避免讲师预先测定的AA浓度与学生在课堂上测定的浓度之间可能出现的不一致。根据样品中AA的总浓度,果汁在支持电解质(0.1 M KCl)中的稀释因子必须在电分析前进行调整。
每种果汁都呈现出特有的CV曲线。与学生讨论了果汁样品伏安图形状的差异,并启发他们思考如何利用收集到的伏安数据来测定未知样品中的AA浓度。在他们得出自己的结论后,强调了使用校准曲线的计算程序。此外,还教导学生如何通过从存在AA时获得的伏安峰()中减去电容电流(;空白)来获得法拉第电流()。电容电流的减法由学生使用他们选择的绘图软件手动进行。空白伏安图中的电流值必须取自在有AA存在的伏安图中观察到的峰电位处(图1A)。所有学生被要求在实验活动结束后24小时内,通过电子邮件或大学内部课程系统提交结果及其计算过程。方案1总结了上述步骤。
好的,这是您所要求文件的完整、忠实、保留原格式和图片引用的中文翻译,其中物理化学名词已加粗处理:
3- 材料与设备
抗坏血酸 (AA, 99%) 和氯化钾 (KCl) 购自Sigma-Aldrich,未经进一步纯化直接使用。商业果汁样品(橙汁、苹果汁和蔓越莓汁;President's Choice品牌)购自当地杂货店。使用蒸馏水配制0.1 M KCl溶液(pH 6.5-7.0),并用该溶液配制12.00 mM的AA储备溶液、1.20 mM的工作溶液和系列标准溶液(0.06、0.12、0.18、0.24和0.30 mM)。玻碳电极(直径3.0 mm)购自BASi (美国),用作工作电极。铂丝购自Strem Chemicals (美国),用作对电极。银/氯化银准参比电极由讲师预先通过简单的电化学方法制备,该方法基于银在酸性介质中存在氯离子的情况下氧化(详细制备过程请见支持信息)。不同
 图1. (A) AA (12.0 mM) 在裸GCE上于0.10 M KCl溶液中的电化学行为,扫描速率为50 mV s⁻¹。法拉第电流 () 通过从峰电流 () 中减去电容电流 () 获得。(B) 在裸GCE上,随着AA浓度增加(0.06、0.12、0.18、0.23和0.30 mM),在50 mV s⁻¹扫描速率下获得的代表性循环伏安图。(C) 显示法拉第电流随AA浓度增加而变化的分析曲线。
图1. (A) AA (12.0 mM) 在裸GCE上于0.10 M KCl溶液中的电化学行为,扫描速率为50 mV s⁻¹。法拉第电流 () 通过从峰电流 () 中减去电容电流 () 获得。(B) 在裸GCE上,随着AA浓度增加(0.06、0.12、0.18、0.23和0.30 mM),在50 mV s⁻¹扫描速率下获得的代表性循环伏安图。(C) 显示法拉第电流随AA浓度增加而变化的分析曲线。
粒径的氧化铝粉(1.0、0.3和0.05 μm)和抛光垫购自Buehler (美国)。本次实践教学活动使用了便携式Metrohm μStat300 恒电位仪和Microsoft Surface Go平板电脑。DropView 8400软件 (Metrohm) 用于数据采集和处理。选择这些恒电位仪是因为它们结构紧凑且配有可充电电池,无需持续供电即可使用,从而增强了装置的实用性。支持信息中提供了具有类似特性的其他设备建议。所有恒电位仪和平板电脑在实验前都已充满电。对于图表绘制,鼓励使用Microsoft Excel和Origin (OriginLab)等工具。2019年,曼尼托巴大学投入约78,000加元的捐赠基金用于购买与此仪器相关的电化学设备。共购买了20台恒电位仪和20台平板电脑。这些设备不仅用于所述实验,还用于二年级分析化学实验室的其他实验方案以及一门四年级的电化学方法课程。
4- 危险与安全
总体而言,本实验活动不使用危险化学品。已知KCl水溶液和AA对人体毒性很低。 氧化铝粉密度低,可能存在吸入风险。因此,指导本课程的学生使用少量该化合物以避免产生粉尘。由于此活动在化学实验室进行,因此需要典型的个人防护装备(丁腈手套、护目镜和实验服)。考虑到本次教学实验中使用的化学品毒性较低,没有产生有毒废物,所有残余物都可以排入常规的水性废物流。
5- 结果与讨论
所述实验是曼尼托巴大学(加拿大温尼伯)化学系为本科生开设的二年级课程“分析实验室方法导论”的一部分。该课程旨在向学生介绍分析化学实验室中的常用技术,包括滴定、光谱法和电分析。测定果汁样品中的AA展示了电分析化学在日常生活中的实用性。这促进了知识的转化,从而提升了学生的学习过程。
我们不要求学生具备电化学方法的先验知识。由讲师录制的强制性讲解视频帮助学生进行准备,熟悉电化学装置和软件,并理解实验的目的。我们收到了学生们压倒性的积极反馈,他们表示该实验对他们的学习体验产生了有益的影响。
在化学实验室中,配制溶液是实验人员必须能够精确执行的最基本任务之一,以获得可靠的定量结果。在本实验中,学生计算了自己溶液的浓度。学生使用分析天平(显示四位小数)称取约0.2克的AA,并将其溶解在100 mL的容量瓶中(使用0.1 M KCl),以配制他们的储备溶液,最终浓度约为0.01 M AA。为了使溶液精确,建议学生考虑转移到容量瓶中的实际重量来计算其储备溶液的摩尔浓度。为此,学生必须考虑固体AA的纯度(本例中为99%)。使用储备溶液,学生进行10倍稀释以配制他们的AA工作溶液,该溶液用于制备伏安定量分析所需的标准品。
由学生组装的电化学装置如图S1所示,同时还展示了所有其他所需试剂和实验室材料。我们的实验室配备了20个可随时使用的电化学工作站(恒电位仪 + 平板电脑),允许学生单独或两人一组进行工作。我们强烈建议讲师准备3-4个额外的备用工作站,以防电化学系统出现功能问题。AA在GCE表面的电化学行为表现出一个明显的氧化峰,如图1A所示,电位在+0.2 V (vs Ag/AgCl)。该反应是化学不可逆的。通过比较在有AA存在时获得的伏安图和在KCl溶液中获得的相应GCE空白伏安图,学生能够清楚地识别和理解电容电流和法拉第电流之间的差异,这对于将电化学用作分析工具至关重要。2022年,所有学生都能在峰电流和峰电位方面获得一致的AA电化学行为,这说明了该电分析方法测定AA的重现性。平均而言,每个小组有两名学生最初遇到问题,这些问题与GCE表面抛光不良有关。通过重新抛光工作电极,这些问题得到了解决。
作为支持电解质的KCl溶液的pH值是所有测量的一个重要参数。为了使用本文描述的电位窗口(-0.1 V至+0.5 V, vs Ag/AgCl),我们建议KCl溶液的pH值接近中性。由于质子参与了AA氧化机理(方案1),阳极电位受pH值变化的显著影响,如果介质pH为碱性或酸性,电位会分别向更低或更高的值移动。 这意味着,如果支持电解质的pH值与中性值有显著偏差,学生可能无法在工作电位范围内观察到氧化峰。因此,必须确认KCl溶液不含酸性或碱性污染物,并且在进行所述活动前检查其pH值。
为了展示分析物浓度变化如何影响伏安实验中的电化学电流峰,我们对浓度从0.06到0.30 mM不等的AA溶液进行了测量。为每种溶液收集了循环伏安图,如图1B所示,随着AA浓度的增加,观察到电化学峰电流明显增加。我们询问学生,当在含有不同浓度分析物的溶液中进行测量时,他们预期峰电流会如何变化。考虑到他们在本课程先前实验中获得的知识,他们能够轻松预测电流信号的行为,并清晰地建立了可被氧化的分子数量与更高电流峰之间的关联。绘制扣除空白后的峰电流 () 与AA浓度的关系图,得到一条线性的校准曲线(图1C),该曲线用于计算三种商业果汁样品中的AA含量。在本活动中,选择蔓越莓汁、橙汁和苹果汁作为真实样品,因为它们AA含量高,使得分析物能够通过循环伏安法 (CV) 在未修饰的GCE上被检测到。
在0.1 M KCl (1:20稀释) 中获得的三种果汁样品的循环伏安图显示出独特的电化学曲线,其中AA的氧化峰在每条曲线中都清晰可辨(图2)。苹果汁在+0.20 V和+0.35 V (vs Ag/AgCl) 附近显示出两个氧化峰,并在+0.27 V (vs Ag/AgCl) 处有一个还原峰。位于+0.20 V的阳极峰归因于AA的氧化,而另外两个峰则是因为基质中存在其他电活性化合物,如酚类物质和糖类。 橙汁和蔓越莓汁仅在+0.30 V (vs Ag/AgCl) 附近显示出一个氧化峰,这也归因于AA的氧化。尽管苹果汁或其他类型的果汁中可能存在其他氧化峰,但只要AA的氧化峰电位是观察到的最低值,测量结果预计是准确的,因为其他物质的干扰仅在更高的电位下发生。果汁样品伏安分析期间获得的电化学曲线与先前的文献非常吻合。
学生被指导为其各自的果汁样品记录至少三次伏安图。使用峰电流(扣除空白后)和先前获得的线性回归方程来计算每个果汁样品中的AA含量,最终结果以
 图2. 苹果汁、橙汁和蔓越莓汁在裸GCE上,于0.10 M KCl (1:20稀释) 中的代表性循环伏安图,扫描速率为50 mV s⁻¹。
图2. 苹果汁、橙汁和蔓越莓汁在裸GCE上,于0.10 M KCl (1:20稀释) 中的代表性循环伏安图,扫描速率为50 mV s⁻¹。
平均值(或更多)± 标准偏差表示。生产商标注的每种果汁样品中的AA含量分别为:蔓越莓汁72 mg,苹果汁90 mg,橙汁60 mg 每250 mL果汁(分别为1.6、2.0和1.3 mM)。学生在本伏安活动中测定的AA含量分别为:蔓越莓汁1.90 ± 0.063 mM(相对标准偏差 (RSD) = 3.31%),苹果汁1.95 ± 0.080 mM(RSD = 4.10%),以及橙汁1.10 ± 0.048 mM(RSD = 4.36%)。这些数字反映了正确执行操作的学生(,占学生的70%)获得的平均结果,并且与标签含量非常吻合。还应注意的是,该电分析方法表现出较高的准确度(两位小数)。未正确执行操作且在准确度上得分低于65%的学生()存在的问题包括电极-恒电位仪连接不正确或松动、空白扣除不当以及电极抛光不良。报告的值与讲师先前测定的值(蔓越莓汁2.07 ± 0.034 mM,RSD = 1.27%;苹果汁2.15 ± 0.010,RSD = 0.44%;橙汁1.45 ± 0.019,RSD = 1.31%)相符,这证实了很高的成功率。正如预期的那样,学生的分析得出的RSD值高于讲师测定的值,这可能是由于电极抛光不完全所致。然而,所有值都低于5.00%,因此在分析上是可以接受的。
虽然AA本身是一种强效抗氧化剂,但果汁的成分中可能含有其他抗氧化剂添加剂,这些添加剂被添加到产品中以增加其保质期和营养价值。 这些分子在AA的伏安测定过程中可能代表潜在的干扰,因为这些化合物可能在相似的电位下氧化。因此,建议讲师提前检查果汁的成分,确保样品中不存在其他抗氧化剂添加剂。这将消除此类化合物对AA氧化电流和电位的干扰,从而获得更准确的结果。
重要的是,讲师必须意识到,根据所选果汁中的AA含量,可能需要调整稀释因子。尽管本文描述了20倍稀释,我们建议有兴趣应用此活动的讲师务必根据生产商标注的AA浓度和校准曲线的限值,确认该因子是否适合他们为活动选择的样品。我们不建议使用AA浓度低于1.0 mM的果汁样品进行此活动。这会显著减少稀释样品所需的支持电解质量,从而降低测量溶液的离子强度和电导率,并最终影响伏安曲线和电流值。
比较AA工作溶液(1.1 mM AA;pH ≈ 3.7;图1A)、AA标准溶液(0.06–0.30 mM;pH在5.8至4.1范围内变化;图1B)和稀释果汁样品(蔓越莓汁,pH ≈ 3.3;苹果汁,pH ≈ 3.7;橙汁,pH ≈ 3.9;图2)的伏安结果时观察到的电位偏移,依赖于它们pH值的差异。AA的电氧化过程伴随着每个分子脱去2个质子,这使得该过程直接依赖于介质的pH值。因此,预期酸性更强的溶液会使阳极峰向更高的电位值移动,这与我们的结果一致。
讲师应向学生强调,在整个实验过程中保持GCE表面抛光良好至关重要,因为这能带来更准确和可重现的结果。另一方面,抛光不良的GCE可能会表现出扭曲的循环伏安图,并产生显著的电流下降和电位偏移,因为氧化后的AA分子会部分吸附在电极表面,堵塞其电活性位点。
好的,这是您所要求文件的完整、忠实、保留原格式和图片引用的中文翻译,其中物理化学名词已加粗处理:
表1. 学生问卷调查 ()
| 问题 | 回答等级 | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| 1. 从1到5分,1分代表“差”,5分代表“优秀”,在学习CHEM2520课程之前,您如何评价自己对电分析方法的了解程度? | 40% | 38% | 17% | 5% | 0 |
| 2. 从1到5分,1分代表“很少”,5分代表“很多”,在完成实验2“果汁中抗坏血酸的电化学测定”后,您对电分析方法的知识增加了多少? | 0 | 0 | 14% | 65% | 21% |
| 3. 从1到5分,1分代表“完全不”,5分代表“非常”,在完成实验前,您对实验2“果汁中抗坏血酸的电化学测定”的兴奋程度如何? | 9% | 17% | 26% | 29% | 19% |
| 4. 从1到5分,1分代表“完全不”,5分代表“非常”,在完成实验2“果汁中抗坏血酸的电化学测定”后,您对学习更多电分析方法有多大兴趣? | 0 | 10% | 12% | 45% | 33% |
| 5. 从1到5分,1分代表“完全没有”,5分代表“非常”,电化学应用于日常样品的普适性在多大程度上让您感到惊讶? | 5% | 5% | 28% | 26% | 36% |
在整个实验过程中,GCE的抛光始终是一个重要参数,它有助于获得可重现且准确的结果。参比电极、对电极和/或工作电极与恒电位仪电缆之间的连接松动会导致伏安图出现噪声或没有电化学响应,这些问题都得到了快速解决。学生们迅速培养了故障排查的意识,并常常能够通过执行进一步的抛光步骤和重新连接所有电缆到恒电位仪来独立解决问题。
为了评估所提出的教学实验的教学成果,我们对2024年参与此活动的学生进行了一项问卷调查。该调查包含5个问题(表1),在实验完成后分发给学生。重要的是,这项调查是匿名进行的。表1显示,绝大多数人(86%)认识到,在完成所提出的实验活动后,他们对电分析的知识显著增加(问题2)。大约50%的学生表示他们对在实验室进行该活动感到兴奋(问题3),而78%的人(问题4)表示有动力在未来学习更多关于电分析方法的知识,这清楚地证明了我们的教学活动受到了学生的积极欢迎,并激发了他们对电化学的兴趣。62%的学生表示(问题5),对于电分析化学——一个对他们大多数人来说至今未知的领域(问题1)——能够如此有效地用于分析日常样品感到惊讶。
该活动还帮助学生应用了在一年级课程中学习的概念和技术,如溶液配制和稀释。此外,还练习了重要的统计概念,如线性回归和考虑标准偏差的结果表达。我们曾邀请学生携带他们在家中消费的样品,并分析自己样品的AA含量。尽管在进行此活动的几次中,学生并未携带样品到实验室,但讲师可以在实验进行前提前强调这种可能性。样品可能包括鲜榨橙汁或柠檬汁、维生素C片剂和化妆品精华液等。重要的是,讲师必须强调,实验室内禁止饮用或食用任何样品。
6- 学生提交物与评估
实验课程结束时,学生会收到一张报告卡(见支持信息),必须填写姓名、小组、日期和未知样品代码等一般信息,以及他们的最终结果。学生被要求在实验课结束后24小时内以电子方式提交此报告卡以及所有计算过程和图表。对于报告单和实验表现的评估,我们考虑了几个重要方面,如下所示,并已包含在支持信息中显示的评分标准中。 (a) 预实验流程:学生应在活动当天之前,在其实验室笔记本中描述实验流程,该流程在实验执行期间由助教检查。 (b) 溶液配制计算:学生需要以 为单位表示所有浓度,并详细展示其计算过程,包括AA储备溶液及其所有稀释液。 (c) 图表绘制:所有循环伏安图(标准溶液和稀释果汁)和校准曲线必须准确绘制,并标明正确的坐标轴标签,如 vs 和 vs AA浓度。图中的所有曲线应以不同颜色/图案显示,并附有适当的图例。 (d) 线性回归分析:最佳拟合线的方程和相关系数应显示在校准图中。 (e) 果汁样品分析:分析样品中的AA浓度应通过使用校准方程,从果汁伏安图的扣除空白后的峰电流计算得出,并以平均值 ± 标准偏差表示。 (f) 实验室安全与态度:在整个实验过程中,学生应始终佩戴个人防护装备(实验服、护目镜和丁腈手套)。 在该活动应用的所有三年中,学生的成功率保持一致。学生在2021年、2022年和2024年的平均成绩分别为78%、77%和80%,三年的总平均成绩为78.3%。这有力地证明了所报告的教学活动具有良好的理解度和高效性。
7- 结论
所报告的实验提供了一个直接且注重动手实践的教学活动,以加深学生对电分析化学实践方面的知识。通过使用便携式且经济高效的仪器,学生能够直观地看到伏安法在定量真实样品中电活性分子方面的巨大潜力。AA的测定和果汁的分析是增强他们学习动机的重要方面,因为分析物和样品类型都普遍存在于学生的日常生活中。所报告的教学方法,基于一系列教学视频,随后在实验课上进行现场指导,受到了二年级理科学生的极大赞赏。在执行此实验的过程中,练习了几个基本概念和技能,如氧化还原反应、电极抛光、电化学装置的设置和功能,以及数据处理,这些都是电分析中的关键因素。还练习了一些统计分析方面的内容,如线性回归和标准偏差计算。希望将此活动纳入其课程的讲师可以通过引入异常值和假设检验等分析,进一步深化统计部分。这个多功能的活动可以进一步扩展到高级课程,以融入发现式学习的方面,这将增强其教学潜力。例如,学生可以利用电化学来研究物理参数(如温度、光照和空气暴露)对所分析果汁中AA浓度的影响。此外,还可以测定和比较鲜榨果汁与浓缩果汁中的AA水平。
尽管曼尼托巴大学捐赠基金需要进行初期投资,但该活动带来的好处远远超过了初始成本。为此,我们想强调电化学设备的多功能性,因为它可以轻松地进行调整,以包括检测各种样品中的其他电活性分析物,例如饮用水中的金属、商业药品中的药物或辣椒酱中的辣度水平。总的来说,我们得出结论,所报告活动的应用可以有效地连接分析电化学的理论和实践方面,我们希望它能激励其他讲师将电分析方法整合到本科课程中。